![]()
- Академия •
- Издательство •
- Конференции •
- Выставки •
- Ученые звания •
- Награды •
- Контакты
РУС | ENG
7. 4. ХАРАКТЕР ЛОКАЛЬНЫХ ВОСПАЛИТЕЛЬНО-ДЕСТРУКТИВНЫХ ИЗМЕНЕНИЙ В ОЧАГЕ ПОРАЖЕНИЯ
Морфологические исследования изменений костной ткани при ОГО свидетельствуют о стадийности течения остеомиелитического процесса и последовательном развитии фазных нарушений структуры костной и мягких тканей: инфильтративного воспаления (соответствует первым суткам заболе-вания); формирования первичного очага поражения (интрамедуллярной флегмоны); распространения воспаления за пределы первичного очага (под-надкостничной, межмышечной и подкожной флегмон) (Четин М.В., 1999; Абаев Ю.К,, 2003).
Характерными признаками инфильтративного воспаления красного ко-стного мозга при ОГО являются отек, полнокровие и замедление кровотока в сосудистом русле. Параллельно развивающиеся нарушения микроциркуля-ции и повышение проницаемости сосудов способствуют миграции клеточ-ных элементов и лейкоцитарной инфильтрации костного мозга, а формиро-вание отека вызывает резкий подъем давления в замкнутом пространстве, приводит к сдавлению венозных сосудов, окончательному стазу крови. Од-новременно присоединяются тромбофлебит и тромбоартериит мелких сосу-дов, нарушаются оксигенация и трофика пораженного участка кости, что за-кономерно заканчивается развитием некроза.
Однако известно, что возникший воспалительный фокус не ограничи-вается первоначальной зоной, а распространяется на другие участки, обу-словливая развитие интрамедуллярной флегмоны. Если первоначальный очаг формируется в центре метафиза, то возникает диффузия медиаторов воспа-ления, биологически активных веществ, продуктов распада тканей, факторов патогенности возбудителей в зоны диафиза и эпифиза, и, соответственно, от-мечается развитие вторичной альтерации в указанных зонах. Наиболее сла-бые костные перекладины истончаются и разрушаются под влиянием лизо-сомальных гидролаз, а экссудат, будучи высокоактивной биологической жидкостью, содержащей протео - и липолитические ферменты, распростра-няется в костной ткани, образуя сложные лабиринты ходов. В результате возникают полости, заполненные гноем и омертвевшими костными фрагмен-тами.
Известно, что красный костный мозг новорожденных, обильно снаб-жаемый кровью, более чувствителен к инфекции, чем желтый костный мозг у взрослых. Рыхлость и сочность костной ткани у детей младшего возраста, легко отслаивающаяся надкостница, обильное кровоснабжение способствуют быстрому распространению воспалительного процесса, определяя остроту течения, быстрый переход на суставы и мягкие ткани. При этом инфекцион-ный процесс распространяется из метафиза в эпифиз через ростовую пла-стинку, деструктивные изменения в кости протекают остро. В первые же дни заболевания зона воспаления захватывает костный мозг, кость, надкостницу. Процессы деструкции кости сначала возникают в костно-хрящевых балках вблизи эпифизарного хряща, который у новорожденных не служит барьером и соответственно не препятствует развитию гнойного артрита.
Ряд авторов подчеркивает, что возникновение флегмоны мягких тканей при ОГО обусловлено не только прорывом гнойника из полости сустава, но и инфицированием мягких тканей за счет распространения микроорганизмов гематогенным путем (сосуды мягких тканей участвуют в кровоснабжении надкостницы). Чем меньше возраст ребенка, тем обширнее деструктивные изменения в эпифизе. При локализации очага воспаления в проксимальном эпифизе бедренной кости возможно развитие патологического эпифизеолиза с формированием подвывиха или вывиха бедра.
В настоящее время четко определены общие закономерности развития сосудистых и тканевых изменений в зоне острого воспалительного процесса инфекционной или неинфекционной природы на молекулярно-клеточном уровне, а также характер системных метаболических расстройств, свойст-венных синдрому системного воспалительного ответа. В связи с этим целе-сообразно остановиться на анализе данных литературы, касающихся молеку-лярно-клеточных механизмов развития альтерации, экссудации, пролифера-ции, свойственных острому воспалительному ответу различного генеза.
Как следует из приведенных выше данных, реакция со стороны кост-ной ткани на действие повреждающего фактора носит фазный характер и проявляется альтерацией, экссудацией и пролиферацией. Одновременно с тканевыми расстройствами возникает комплекс сосудистых изменений в ви-де кратковременного спазма, артериальной гиперемии, венозной гиперемии и стаза.
Альтерация тканей в зоне воспаления, в частности костной при ОГО, по мнению многих авторов, характеризуется типовыми нарушениями струк-туры и функции биологических мембран, трофики и обмена веществ в зоне инокуляции инфекционного патогенного агента. Различают биохимическую и морфологическую фазы альтерации. Интенсивность биохимических изме-нений в зоне повреждения тканей (образование вазоактивных и хемотаксиче-ских факторов) определяет стереотипный характер сосудистых и тканевых изменений.
В настоящее время, очевидно, что медиаторы биохимической фазы альтерации в зависимости от времени и источников происхождения подраз-деляются на гуморальные и клеточные. Гуморальные медиаторы: кинины, активные компоненты комплемента, факторы систем гемостаза и фибриноли-за - преимущественно пептидной природы, активируются путем ограничен-ного протеолиза. Медиаторы клеточного происхождения классифицируются как предшествующие и вновь синтезированные.
Касаясь роли клеточных медиаторов в развитии воспалительной реак-ции, следует отметить, что они могут освобождаться в активированном со-стоянии из депо (вазоактивные амины: гистамин, серотонин; лизосомальные ферменты, неферментные катионные белки, нейропептиды: вещество Р, кальцитонинген -связанный пептид, нейрокинин). К числу вновь синтезиро-ванных медиаторов воспаления относятся метаболиты арахидоновой кисло-ты: простагландины, тромбоксаны, лейкотриены; цитокины, ферменты, ак-тивные метаболиты кисло-рода: гидроксил, супероксиданион-радикал, пер-гидроксил, перекись водорода, синглетный молекулярный кислород) клеточ-ные медиаторы.
Останавливаясь на значимости избыточного освобождения биогенных аминов в зоне альтерации, необходимо отметить, что эффект гистамина на сосудистую стенку в зоне острого воспаления реализуется через Н1- рецеп-торы в виде вазодилатации и повышения проницаемости. Помимо этого, в очаге воспаления гистамин вызывает боль, повышает адгезивные свойства эндотелия сосудов, способствует эмиграции лейкоцитов. Однако биологиче-ские эффекты этого медиатора кратковременны вследствие быстрого разру-шения под влиянием фермента гистаминазы (Клименко Н.А., Титарко С.В., 1995).
Одновременно с освобождением гистамина из тучных клеток, под влиянием различных активаторов (коллагена, тромбина, фактора активации тромбоцитов, аденозиндифосфата), происходит секреция серотонина из тромбоцитов и хромаффинных клеток, который в умеренных концентрациях вызывает расширение артериол, сокращение миоцитов в стенках венул, ве-нозный застой. В высоких концентрациях серотонин обусловливает спазм артериол (Симоненко А.П. и соавт., 1998).
Ряд авторов отмечают, что инициирующая роль в высвобождании ме-диаторов воспаления в зоне альтерации, помимо гистамина, принадлежит нейро- и липидомедиаторам. По их мнению, в первые секунды после повре-ждения сенсорные пептидергические волокна, участвующие в ноцицепции, выделяют особые сенсорные нейропептиды: субстанцию Р, пептид гена, род-ственного кальцитонину, пептид протеинового гена. Указанные нейромедиа-торы вызывают выраженную вазодилатацию, а также индуцируют экспрес-сию молекул межклеточной адгезии на поверхности лейкоцитов и эндотели-альных клеток, стимулируя тем самым эмиграцию лейкоцитов (Хитров Н.К., 1995).
Другими исследователями отмечен тот факт, что сенсорные нейропеп-тиды стимулируют продукцию макрофагами цитокинов, влияют на иммуно-генез, модулируют пролиферацию Т-лимфоцитов (Игнатьева Г.А., 1997).
Установлено, что вслед за мгновенным воздействием сенсорных ней-ропептидов в течение следующих минут важная роль в развитии альтерации и сосудистых изменений отводится медиаторам липидного происхождения (простаноиды: простагландины, простациклины и тромбоксан; эйкозаноиды: лейкотриены, перекиси и гидроперекиси жирных кислот) (Марков Х.М. и со-авт., 1997). Вышеназванные исследователи отмечают, что простагландины, взаимодействуя со специализированными рецепторами клеточных мембран, обладают вазоактивным действием, сенсибилизируют сенсорные пептидер-гические нервные волокна, что способствует появлению боли в очаге воспа-ления.
Образующиеся в зоне альтерации простациклины и тромбоксаны влияют на степень проницаемости сосудистой стенки и интенсивность агре-гации тромбоцитов. Под влиянием тромбоксана А2 в просвете микрососудов зоны острого воспаления происходит агрегация тромбоцитов, опосредован-ная торможением активности аденилатциклазы. Одновременно тромбоксан вызывает сокращение гладкомышечных элементов стенок сосудов микро-циркуляторного русла. По мнению ряда авторов, биологический смысл про-дукции тромбоксана при воспалении заключается в отграничении зоны аль-терации как очага инфекции от окружающих тканей за счет спазма сосудов микроциркуляции и формирования тромбов.
Лейкотриены синтезируются из арахидоновой кислоты в мембранах клеток под влиянием фермента липоксигеназы; они являются хемотаксиче-скими агентами, способствуют миграции полиморфонуклеаров, усиливают экзоцитоз ими протеолитических ферментов, синтез и освобождение свобод-ных радикалов в очаге острого воспаления (Ерюхин И.А., Шляпников С.А., 1997).
Кроме того, в зоне альтерации полиморфноядерные лейкоциты выде-ляют так называемые гранулоцитарные факторы – катионные белки, ней-тральные и кислые протеазы. Катионные белки содержатся в азурофильных и специфических гранулах нейтрофилов, обеспечивают высокую бактерицид-ность в синергическом взаимодействии с системой миелопероксидаза – пере-кись водорода. Воздействуя на сосуды микроциркуляторного русла, катион-ные белки повышают их проницаемость, а также стимулируют хемотаксис моноцитов, имигрируют миграцию гранулоцитов.
Продуцируемые в зону воспаления нейтральные протеазы (эластаза, коллагеназа) вызывают деструкцию волокон базальной мембраны сосудов и повышение их проницаемости, обусловливают дезинтеграцию волокнистых структур межуточной соединительной ткани. Кислые протеазы лейкоцитов активируются в условиях ацидоза, развивающегося в зоне острого воспали-тельного процесса, воздействуют на мембраны собственных клеток макроор-ганизма, а также на инфекционных возбудителей воспаления.
Данные литературы свидетельствуют, о том что на фоне антигенной стимуляции моноциты/макрофаги и некоторые другие клетки (лимфоциты, гепатоциты, глиальные клетки и др.) продуцируют более 100 биологически активных веществ (клеточных медиаторов воспаления) (Володин Н.Н., Дег-тярева М.В. и соавт., 2000). В настоящее время принята следующая класси-фикация монокинов, оказывающих локальные и системные биологические эффекты:
1. Протеазы: активатор плазминогена, коллагеназа, эластаза, ангиотензин конвертаза.
2. Медиаторы воспаления и иммуномодуляции: фактор некроза опухоли (ФНО), интерлейкины (ИЛ) – 1, -3, -6, -8, -10, -12, -15, интерферон, лизоцим, фактор активации нейтрофилов, компоненты комплемента С, С2, С3, С5.
3. Факторы роста: колониестимулирующие факторы (гранулоцитарный, гранулоцитарно-макрофагальный, мульти-КСФ), фактор роста фибробластов, трансформирующий фактор роста.
4. Факторы свертывающей системы и ингибиторы фибринолиза:V, VII, IX, X, ингибиторы плазминогена, плазмина.
5. Адгезивные вещества: фибронектин, тромбоспондин, протеингликаны.
По мнению ряда авторов, важную роль в индукции воспалительной ре-акции играют ИЛ-1, ИЛ-6, ИЛ-8, ФНО и др. Так, ИЛ-1 стимулирует выход полиморфноядерных лейкоцитов из костного мозга, вызывает экспрессию эндотелиально-лейкоцитарных адгезивных молекул (ЭЛАМ) на поверхности эндотелиоцитов и лейкоцитов, способствует краевому стоянию лейкоцитов и стимулирует процесс их эмиграции. Кроме того, ИЛ-1 вызывает экзоцитоз лизосомальных ферментов и свободных радикалов фагоцитами, которые подвергают деструкции нежизнеспособные клеточные элементы и бактери-альные клетки; является фактором клеточного роста (усиливает пролифера-цию фибробластов и повышает синтез коллагена); в качестве флогогена сти-мулирует дегрануляцию тучных клеток с освобождением медиаторов воспа-ления, активирует продукцию простациклина; индуцирует синтез коллагеназ и активатора плазмина в тканях, способствуя повышению секреции синови-альной жидкости и резорбтивным изменениям в костной и хрящевой ткани (Кетлинский С.А., 1999).
Некоторые исследователи указывают на важную роль ИЛ-6, который является стимулятором пролиферации костномозговых клеток предшествен-ников гранулоцитов и макрофагов, что приводит к увеличению выхода в кровоток зрелых форм этих клеток, восполняющих утраченные в ходе воспа-ления.
Интерлейкин-8 обусловливает активацию хемотаксиса и краевого стоя-ния различных видов лейкоцитов, стимулирует освобождение дефензинов из нейтрофилов и таким образом усиливает противовоспалительный ответ на внедрившиеся микроорганизмы.
ФНО в зоне острого воспаления усиливает основные функции лейко-цитов, стимулирует выброс гистамина базофилами и тучными клетками, вы-зывает активацию фибробластов, гладких миоцитов и эндотелия сосудов.
Важная роль в развитии сосудистых и тканевых изменений в очаге вос-паления принадлежит фосфолипидному фактору активации тромбоцитов (ФАТ). ФАТ образуется из материала клеточных мембран под влиянием фосфолипазы А2 . Источниками ФАТ являются клетки эндотелия, тканевые базофилы, тромбоциты, нейтрофилы, моноциты, макрофаги, эозинофилы, ба-зофилы крови. ФАТ вызывает дегрануляцию базофилов, активирует хемо-таксис нейтрофилов, повышает проницаемость сосудов, оказывает сосудосу-живающее действие и стимулирует агрегацию тромбоцитов.
Важная роль в развитии локальных и системных метаболических рас-стройств у детей с острым гематогенным остеомиелитом отводится актива-ции процессов свободнорадикального окисления. Как показали результаты проведенных исследований, при локальной форме вышеуказанной патологии имеют место активация процессов липопероксидации, накопление продуктов перекисного окисления липидов на фоне инактивации ферментного и нефер-ментного звеньев антиоксидантной системы крови (Чеснокова Н.П., Морри-сон В.В. и соавт., 2004).
Касаясь механизмов активации процессов образования свободных ра-дикалов (синглетный кислород, супероксидный анион радикал, гидроксиль-ный радикал, пергидроксил) в очаге воспаления тканей при остром гемато-генном остеомиелите, следует отметить что, важная роль в генерации сво-бодных радикалов отводится фагоцитам, выбрасывающим их в окружающую среду в ходе так называемого окислительного или метаболического взрыва. Активные метаболиты кислорода, с одной стороны, обеспечивают бактери-цидную активность фагоцитов, а с другой, - вызывают разрушение межкле-точного матрикса, оказывают повреждающее действие на фибробласты.
Ряд исследователей отмечает тот факт, что окисид азота, выделяющий-ся из эндотелия сосудов, макрофагов, нервных элементов, является мощным вазодилататором в очаге острого воспаления, ингибитором агрегации тром-боцитов, инактивирует клеточное железо, оказывая цитостатическое и цито-литическое действия (Проскуряков С.Я., Коноплянников А.Г. и соавт., 1999).
Таким образом, каскад локальных деструктивных изменений в костной ткани при остром гематогенном остеомиелите обеспечивается накоплением в зоне инокуляции инфекции значительного количества активированных поли-морфноядерных лейкоцитов, моноцитов, тканевых макрофагов, фибробла-стов, интенсивно продуцирующих гамму биологически активных веществ, которые обладают мощным местным альтерирующим действием, а при ре-зорбции в системный кровоток индуцируют развитие преиммунного ответа, системных метаболических и функциональных сдвигов.

 С 14 по 17 марта 2024 г. Академия Естествознания приняла участие в XXXI МИНСКОЙ МЕЖДУНАРОДНОЙ КНИЖНОЙ ВЫСТАВКЕ «ММКВЯ-2024», которая прошла в Административном выставочном комплексе БелЭкспо.
С 14 по 17 марта 2024 г. Академия Естествознания приняла участие в XXXI МИНСКОЙ МЕЖДУНАРОДНОЙ КНИЖНОЙ ВЫСТАВКЕ «ММКВЯ-2024», которая прошла в Административном выставочном комплексе БелЭкспо.
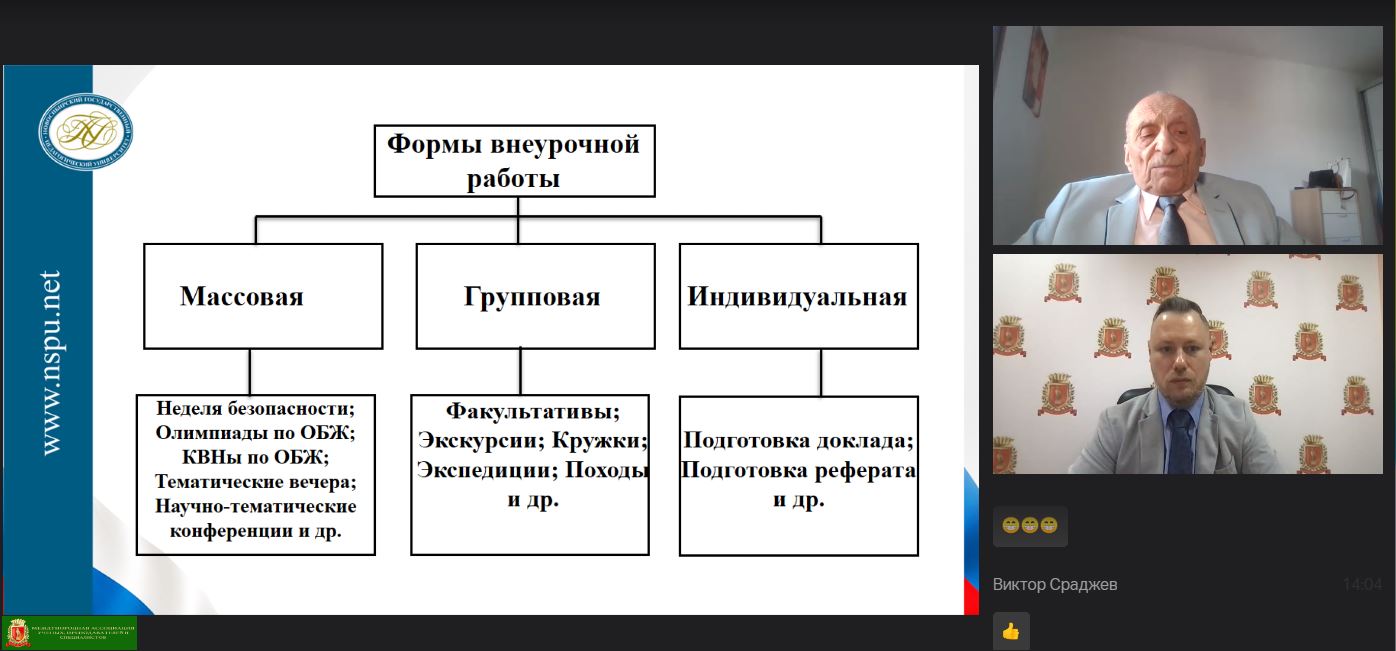 30 января Академией естествознания в рамках дистанционных педагогических проектов была проведена научно-практическая конференция "ПРИОРИТЕТНЫЕ НАПРАВЛЕНИЯ РАЗВИТИЯ СОВРЕМЕННОГО ОБРАЗОВАНИЯ" для педагогов средних, средних специальных и высших учебных заведений.
30 января Академией естествознания в рамках дистанционных педагогических проектов была проведена научно-практическая конференция "ПРИОРИТЕТНЫЕ НАПРАВЛЕНИЯ РАЗВИТИЯ СОВРЕМЕННОГО ОБРАЗОВАНИЯ" для педагогов средних, средних специальных и высших учебных заведений.
18-22 октября 2023 года Франкфуртская книжная выставка
 Российская Академия Естествознания приняла участие в прошедшей 18-22 октября 2023 года 75-ой Франкфуртской книжной выставке Frankfurter Buchmesse 2023
Российская Академия Естествознания приняла участие в прошедшей 18-22 октября 2023 года 75-ой Франкфуртской книжной выставке Frankfurter Buchmesse 2023
 15 ноября Академией естествознания в рамках дистанционных педагогических проектов была проведена научно-практическая конференция "СОВРЕМЕННОЕ ОБРАЗОВАНИЕ. ПРОБЛЕМЫ И РЕШЕНИЯ" для педагогов средних, средних специальных и высших учебных заведений.
15 ноября Академией естествознания в рамках дистанционных педагогических проектов была проведена научно-практическая конференция "СОВРЕМЕННОЕ ОБРАЗОВАНИЕ. ПРОБЛЕМЫ И РЕШЕНИЯ" для педагогов средних, средних специальных и высших учебных заведений.
© 2005–2020 Российская Академия Естествознания
Телефоны:
+7 499 709-8104, +7 8412 30-41-08, +7 499 704-1341, +7 8452 477-677, +7 968 703-84-33
+7 499 705-72-30 - редакция журналов Издательства
Тел/Факс: +7 8452 477-677
E-mail: stukova@rae.ru
Адрес для корреспонденции: 101000, г. Москва, а/я 47, Академия Естествознания.
Служба технической поддержки - support@rae.ru

